波睿达生物首款细胞治疗药物BRD-01获美国FDA孤儿药资格认定
2024年1月29日,武汉波睿达生物科技有限公司(简称“波睿达生物”)宣布,其自主研发的CAR-T细胞治疗药物BRD-01(靶向CD30嵌合抗原受体基因修饰的自体T细胞注射液)获得了美国食品药品监督管理局(FDA)授予孤儿药资格认定(Orphan Drug Designation, ODD),用于治疗间变性大细胞淋巴瘤(Anaplastic Large Cell Lymphoma, ALCL)。
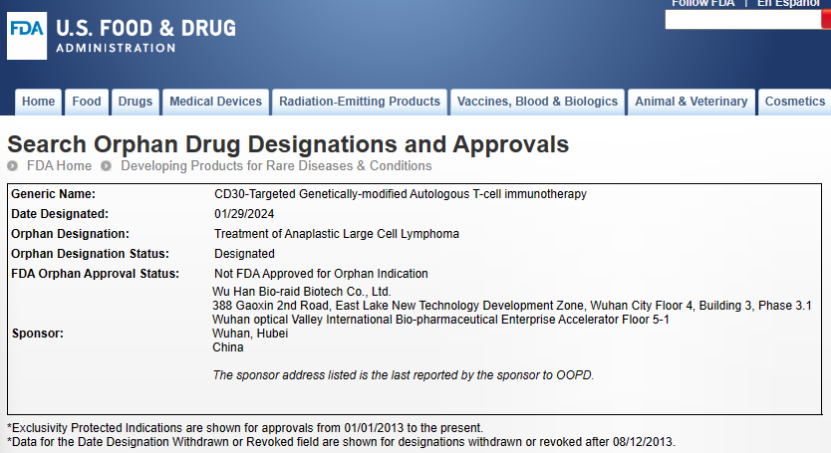
ODD是美国FDA孤儿药开发办公室(Office of Orphan Products Development,OOPD)对符合条件的用于预防、治疗及诊断罕见病的药物(包括生物制品)授予的一种资格认定。一个在研药物(包括生物制品)能在ODD申请中证明其在治疗、预防或诊断一种罕见病的潜力,OOPD在审评申请资料后将会授予该药物ODD。在获得ODD后,该款产品将有资格享受若干优惠政策,包括FDA对临床研究指导支持、特殊费用减免、在美国享受上市申请快速通道,以及批准上市后产品在美国的七年市场独占权等。
BRD-01于2020年4月20日获得国家药品监督管理局(NMPA)临床试验默示许可,用于治疗CD30+复发/难治性血液肿瘤。该产品靶点CD30是一种跨膜蛋白,高表达于间变性大细胞淋巴瘤(Anaplastic Large Cell Lymphoma, ALCL)和霍奇金淋巴瘤(Hodgkin lymphoma, cHL)细胞表面,是HL及ALCL的临床诊疗标记物。BRD-01已完成的I期临床试验数据显示,BRD-01具有良好的安全性特征,临床试验纳入的所有受试者均未发生超过3级的CRS,也未发生神经毒性,并且在治疗的CD30阳性淋巴瘤患者中获得了91.7%的最佳缓解率(其中5例为CR,6例为PR),目前BRD-01正在有序推进II期临床试验。此次BRD-01获得ODD,是FDA对波睿达生物核心技术和产品的高度认可,同时也是波睿达生物坚持面向全球市场专注First-in-class产品研发战略的一次重大胜利。
关于间变性大细胞淋巴瘤
间变性大细胞淋巴瘤(Anaplastic Large Cell Lymphoma, ALCL)是一种侵袭性非霍奇金淋巴瘤,一致性强表达CD30。
ALCL的初始治疗通常包括联合化疗合并或不合并自体造血干细胞移植(HCT)或放射治疗。对于局部疾病的患者,局部治疗如手术切除或放射治疗可使完全缓解率>90%[1]。然而,尽管有这些积极的治疗形式,但大多数全身性ALCL患者远期极易复发。目前,对于复发/难治性ALCL的最佳治疗方案尚无共识。ALCL仍然是一个未满足的医疗需求,需要新的和更有效的治疗方法。
关于BRD-01
BRD-01是由武汉波睿达生物科技有限公司自主研发,针对确诊为复发/难治性CD30+血液肿瘤患者的CAR-T细胞治疗药物,也是国内首个被批准临床试验默许以CD30为靶点的CAR-T细胞治疗产品,有望成为全球首个该靶点CAR-T产品新药。
关于波睿达生物
武汉波睿达生物科技有限公司是一家致力于CAR-T免疫细胞药品研发、中试和申报于一体的制药企业,成立于2014年9月,由武汉科技大学生命科学与健康学院院长张同存教授领衔,来自国内外著名一流高校及科研机构的免疫学专家、临床医学专家、细胞生物学家联合创建的高科技创新型企业。
目前拥有6000多平方米的研发、中试车间。厂房布局由专业设计院根据药品研发生产严格要求设计,各车间场地、设施均符合GMP的要求,并拥有现代化的研发-小试-中试-申报流程化平台和质量控制平台。形成了以血液肿瘤CAR-T为主导,**感染性疾病CAR-T、实体肿瘤CAR-T和通用CAR-T等多个研发项目并行推进的研发体系。
波睿达已申请国家专利60余项,获专利授权20余项;血液肿瘤CAR-T针对白血病、淋巴瘤、多发性骨髓瘤已拥有CD30、CD19/22、CD99、CD20、BCMA等多个成熟靶点,已完成数百例临床试验研究。