药事日报491期 | 罗氏近10亿美元引进病毒免疫疗法!艾伯维2.55亿美元现金收购DJS!

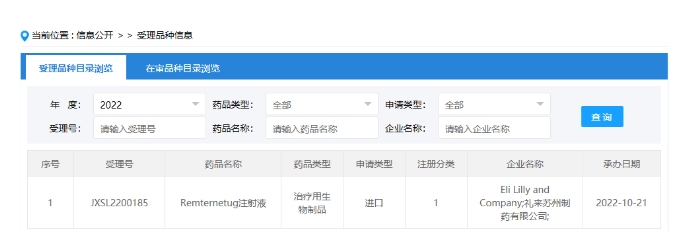
罗氏近10亿美元引进**免疫疗法 10月20日,罗氏与HookipaPharma达成战略合作和许可协议,共同开发用于KRAS突变癌症的HB-700和第2种未公开的新型沙粒**免疫疗法。 根据协议条款,罗氏将向Hookipa支付2500万美元的预付款,后者还有资格获得HB-700与其他候选产品的开发和商业化里程碑付款(总额约为9.3亿美元),以及高个位数至双位数的销售分层提成。 此外,罗氏有权通过增加一个额外的候选产品来扩大初始合作,之后HOOKIPA将在期权行使中收获额外的1500万美元付款。 来源:医药魔方 国产首款!贝达药业TEAD***申报临床 10月20日,贝达药业发布公告宣布,其自主研发的TEAD***BPI-460372的临床试验申请已获CDE受理,申请的适应症为晚期实体瘤。目前,全球尚无靶向TEAD蛋白的小分子***上市。 Hippo信号通路是一种肿瘤抑制通路,其活性由转录辅因子Yes相关蛋白(YAP)和具有PDZ结合基序(TAZ)的转录辅激活因子介导,后二者可与转录增强因子(transcriptional enhanced associate domain,TEAD)相互作用以调节基因表达。研究表明,TEAD在多种肿瘤中表达上调,包括胃癌、结肠直肠癌、乳腺癌和前列腺癌,其与患者的不良生存率相关。 来源:贝达药业 艾伯维2.55亿美元现金收购DJS 10月20日,艾伯维宣布收购DJS Antibodies(简称DJS)。根据协议,艾伯维将在交易结束时向DJS股东支付约2.55亿美元现金,用于收购。DJS股东仍然有资格获得与DJS-002项目相关的里程碑付款。艾伯维预计将保留所有的现任DJS员工及其在牛津的工厂。 DJS专有的HEPTAD平台基于一种新颖的抗体发现技术,极大地提高了G蛋白偶联受体(GPCR)相关的功能性抗体的发现率,这些靶点之前一直难以用于生物制药。艾伯维利用该平台来补充扩展了其生物治疗研究方面的能力。 来源:医药观澜 GSK带状疱疹保护效力长达10年 10月19日,GSK宣布,ZOSTER-049扩展研究收获积极中期结果:Shingrix可为50岁及以上成人提供至少10年的带状疱疹保护效应。 Shingrix是继Zostavax之后FDA批准的第2款带状疱疹疫苗。2019年5月,Shingrix又获NMPA有条件批准上市,用于50岁及以上成人带状疱疹的预防。此疫苗在各个年龄段预防带状疱疹和后续神经痛的有效率超过90%,而默沙东的Zostavax有效率仅有60%-70%。 来源:医药魔方 圣湘生物前三季度营收超40亿元,研发同比增长97% 10月20日晚间,圣湘生物披露2022年三季报,前三季度公司实现营业收入40.68亿元,同比增长24.52%;净利润15.98亿元,同比下滑9.04%。其中,第三季度营收13.78亿元,同比增长11.25%;净利润4.73亿元,同比下滑25.59%。 值得注意的是,前三季度圣湘生物研发投入达1.80亿元,同比增长高达97.44%,远超营收增速。 圣湘生物成立于2008年,是集诊断试剂、仪器、第三方医学检验服务为一体的体外诊断整体解决方案提供商。随着三季度报告的出炉,公司增收不增利状态显露,似乎仍未完全走出核酸检测红利期缩短带来的影响。与此同时,公司股价也持续走低,截至目前,已较上市首日最高点153.68元/股跌去8成。 来源:圣湘生物 下一代Aβ单抗!礼来阿尔茨海默症新药在国内申报临床 10月21日,CDE官网显示,礼来remternetug(LY3372993 )注射液临床试验申请获受理,用于治疗阿尔茨海默症(AD)。礼来表示,它是donanemab的后续产品,属于“下一代抗淀粉样蛋白抗体”。 Donanemab是礼来在研的一款靶向被称为N3pG的修饰化β淀粉样蛋白斑块抗体药物,曾获FDA的突破性疗法认定。据悉,礼来已经启动donanemab的*动上市申请,以寻求美国FDA的加速批准。今年4月,该产品在国内获批治疗AD的临床。 礼来研发日透露,remternetug在开展的1b期临床中表现出深度斑块清除能力,并拥有良好的安全性。 来源:医药魔方 每日一次!辉瑞「托法替布缓释片」新适应症在华获批上市 10月21日,药监局官网显示,辉瑞枸橼酸托法替布缓释片新适应症在华获批上市。 托法替布是辉瑞开发的一款JAK***,目前全球已经获批的适应症有类风湿性关节炎、溃疡性结肠炎和银屑病关节炎、幼年特发性关节炎和强直性脊柱炎。 自上市以来,托法替布销售额稳步上升,2021年销售额高达24.55亿美元,2022H1给辉瑞带来了8.02亿美元的收入。目前,国内已有2款枸橼酸托法替布缓释片仿制药上市,分别是齐鲁制药和石药集团。值得一提的是,石药集团也是今日获批上市。 来源:药监局官网 刚刚!葛兰素史克双药**病疗法在中国获批 今日(10月21日),中国国家药监局(NMPA)官网最新公示,由葛兰素史克(GSK)提交的双药HIV疗法——多替拉韦利匹韦林片的新药上市申请已获得批准。根据中国国家药监局药品审评中心(CDE)优先审评公示,此次获批的适应症为治疗特定成人人类免疫缺陷**1型(HIV-1)感染患者。值得一提的是,该药也是首款获得FDA批准针对**学抑制的患者进行维持治疗的双药疗法。相比含有不少于3款药物的HIV治疗方案,限制HIV疗法中的药物数量有望减少对患者的毒性。 多替拉韦利匹韦林是ViiV Healthcare公司(GSK拥有主要股权)推出的一款双药HIV疗法。其中,多替拉韦(dolutegravir)是一种HIV-1整合酶链转移***(INSTI),能够阻止HIV**进入细胞,可与其他抗逆转录**药物联合使用,治疗感染HIV-1的成人患者。利匹韦林(rilpivirine)是一种体积很小(25mg)的口服非核苷逆转录酶***(NNRTI),具有疗效确切,安全性与耐受性良好等特点。 研究表明,多替拉韦利匹韦林能有效抑制HIV**,效果与这些志愿者曾使用的抗HIV疗法相当。在SWORD 1和SWORD 2研究的汇总分析和单独分析中,与三药或四药方案相比,多替拉韦利匹韦林方案在48周时实现了非劣效的**抑制,治疗组之间的抑制率相似。 来源:医药魔方