药事日报434期 | 复星医药44亿元定增方案出炉!高毅资产将成第三大股东!

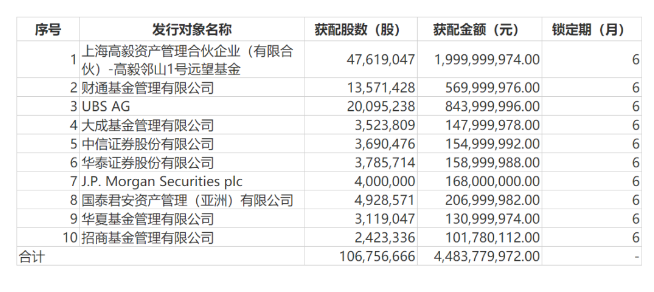
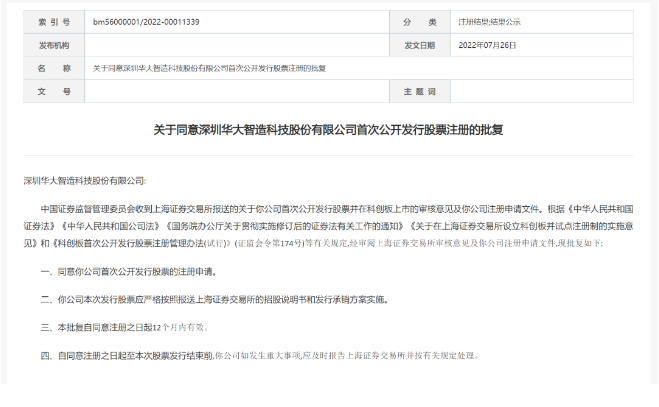
3.5亿美元!传奇生物将完成公开发售募资 7月27日,金斯瑞科技发布公告,其非全资附属子公司传奇生物确定了公开发售价格为每股美国存托股份43美元,所得款项总额共约3.5亿美元。 此外,传奇生物已向承销商授予30日购股权,可按公开发售价(减去承销折扣及佣金)购买最多额外1,221,000股美国存託股份。 所有美国存託股份均由传奇生物发售。发售预期于2022年7月29日完成,惟须待惯常的完成条件达成。 来源:医药魔方 复星医药44亿元定增方案出炉! 7月26日晚间,复星医药披露了增发结果公告,最终发行价格为42.00元/股、发行股数为1.07亿股、募集资金总额为44.84亿元。 定增投资情况 图片来源:上市公司公告 参与复星医药定增的投资者名单尽数揭晓,包括瑞银集团、JP摩根、中信证券、招商基金等在内的10名境内外机构。最终,高毅资产获配近20亿元,成为本次定增获配金额最大的机构;UBS获配8.44亿元,排名其次,财通基金获配5.7亿元,获配金额位列第三。 值得注意的是,本次发行完成后,高毅资产将成为复星医药第三大股东,持股比例为1.78%,瑞银集团和财通基金则分别为第六和第九大股东。 来源:复星医药 华大智造科创板IPO注册获证监会同意 2022年7月26日,证监会官网发布公告称,同意华大智造科创板IPO注册。 科创板官网显示,华大智造科创板IPO,已经于2021年9月2日成功过会,并于2021年9月10日提交注册。 华大智造专注于生命科学与生物技术领域,以仪器设备、试剂耗材等相关产品的 研发、生产和销售为主要业务,为精准医疗、精准农业和精准健康等行业提供实 时、全景、全生命周期的生命数字化设备和系统解决方案。 来源:华大智造 超9亿美元!科伦博泰授权默沙东又一ADC药物 7月26日,科伦博泰 (科伦药业的控股子公司),一家专注于生物技术药物及创新小分子药物的生物科技公司,宣布与默沙东达成合作及独家许可协议,开发一款用于治疗实体瘤的抗体偶联物(ADC)药物。 根据协议内容,科伦博泰将有偿独家许可默沙东在全球范围内进行研发、生产与商业化该款ADC药物。双方还将对该款ADC药物的早期临床开发进行合作。默沙东将根据协议内容和商业化开发阶段向科伦博泰支付3500万美金首付款、不超过9.01亿美金的各类里程碑付款及相应净销售额提成。 来源:科伦博泰 康哲药业从友芝友生物购进眼科VEGF/ANG2双抗产品 7月26日,康哲药业宣布附属子公司康哲眼科与友芝友生物制药订立资产转让协议,购得玻璃体腔内注射用靶向VEGF和ANG2的四价双特异性抗体在全球范围的使用、开发、注册、生产、委托生产、销售、经销、推广及商业化权利,以及产品的所有知识产权。 该双抗产品用于治疗眼底新生血管疾病,采用独特的纳米抗体设计,同时靶向VEGF(血管内皮生长因子)和ANG2(血管生成素2),通过两种不同的通路有效抑制新生血管异常生长,具有亲和力高、抑制活性强、制剂浓度高、稳定性好、给药频率低的优势,可减少患者因频繁的玻璃体腔内注射所造成的潜在风险,提高患者的用药依从性,具有重要的临床意义。该双抗产品目前处于临床前阶段。 来源:康哲药业 “医药界诺贝尔奖”公布候选名单,百济神州BTK***首次上榜 今日,美国盖伦基金会(The Galien Foundation)宣布了2022年盖伦奖(Prix Galien USA Awards)的候选名单。被誉为“医药界的诺贝尔奖”的盖伦奖被公认为是医药和生物医疗行业的最高荣誉,它表彰为改善人类健康做出的杰出科学创新。 2022年盖伦奖的候选名单包括最佳生物技术产品奖(Best Biotechnology Product),最佳药品奖(Best Pharmaceutical Agent),最佳医疗技术奖(Best Medical Technology)三个类别。它们均为最近5年内获得美国FDA批准上市,并且有潜力对人类健康产生重大影响的产品。 值得一提的是,百济神州公司开发的新一代布鲁顿氏酪氨酸激酶(BTK)***泽布替尼(zanubrutinib,英文商品名Brukinsa)首次列入最佳生物技术产品奖候选名单。泽布替尼在2019年首次被美国FDA批准上市,用于治疗经治成人套细胞淋巴瘤患者。此后,它又获得FDA批准治疗成年华氏巨球蛋白血症(WM)患者和复发/难治性边缘区淋巴瘤(MZL)成年患者。 来源:药明康德 每月一次皮**射!礼来偏头痛新药在中国申报上市 7月26日,中国国家药监局药品审评中心(CDE)官网公示,礼来公司(Eli Lilly and Company)在中国递交了一项galcanezumab注射液上市申请。公开资料显示,galcanezumab是一款CGRP受体拮抗剂,可每月一次由患者自我皮**射,该药已经获美国FDA批准用于成人偏头痛的预防性治疗以及减少成人阵发性丛集性头痛发作频率。此外,该药早先已经在以中国患者为主的全球多中心3期临床研究中取得积极主要研究结果,用于预防性治疗成人发作性偏头痛。 2021年9月,礼来中国宣布galcanezumab用于预防性治疗成人发作性偏头痛的全球多中心3期临床研究(CGAX研究)取得积极主要研究结果。CGAX研究是一项前瞻性、全球多中心、随机、双盲、安慰剂对照的3期研究,入组人群以中国患者为主,旨在评估galcanezumab对预防性治疗成人发作性偏头痛的有效性和安全性。 来源:医药观澜 吉利德科学引进!TIGIT抗体在中国获批临床 中国国家药监局药品审评中心(CDE)官网公示,一款名为domvanalimab注射液的1类新药获得临床试验默示许可,拟开发适应症为:联合PD-L1***durvalumab用于治疗肿瘤表达PD-L1且同步放化疗后疾病未进展的不可切除性局部晚期(III期)非小细胞肺癌(NSCLC)。公开资料显示,domvanalimab是吉利德科学(Gilead Sciences)引进的一种去除抗体Fc端功能的抗TIGIT抗体,目前在全球已进展至3期临床研究阶段。 来源:医药观澜